Des essaims de nanorobots magnétiques pour destructurer les biofilms bactériens et lutter contre la résistance aux antibiotiques
Publié par IPBS Toulouse, le 30 janvier 2025 280
Les infections causées par les bactéries regroupées en biofilm sont très difficiles à traiter. Dans une étude publiée dans Advanced Healthcare Materials des scientifiques montrent qu’une nouvelle catégorie de nanoparticules, les nanochaînes magnétiques sont capables de déstructurer les biofilms avec une efficacité sans précèdent. Cette déstructuration améliore considérablement l’action des antibiotiques, ouvrant ainsi la voie à de nouvelles perspective dans la lutte contre les résistances bactériennes.
Les biofilms bactériens, des structures qui renforcent la résistance aux antibiotiques
Les
biofilms sont des regroupements de bactéries entourées d’une couche
protectrice, la matrice extracellulaire. Composée de substances
polymériques extracellulaires (polysaccharides, protéines, lipides et
ADN), cette matrice agit comme une barrière physique et chimique,
rendant les biofilms extrêmement résistants aux traitements et aux
cellules immunitaires. Ces ensembles sont impliquées dans de nombreuses
infections chroniques et contribuent à l’échec des traitements
antimicrobiens. Par conséquent, il est crucial de développer des
stratégies innovantes, non conventionnelles et performantes pour
renforcer l’action des antibiotiques, notamment en ciblant directement
la matrice des biofilms.
Mécanisme d’action des nanochaînes magnétiques
Pour relever ce défi, dans un article publié dans Advanced Healthcare Materials,
des scientifiques présentent une solution basée sur l’utilisation de
nanochaînes magnétiques. Inspirées par les bacilles planctoniques, ces
structures allongées regroupent de multiples nanoparticules de maghémite
superparamagnétiques et possèdent des propriétés uniques qui permettent
une manipulation précise sous l’effet de champs magnétiques. Notamment,
elles peuvent être manipulé à distance, former des structures plus
grandes en fonction de l’intensité du champ, créer localement des
structures tournantes et se redispersent en l’absence du champ.
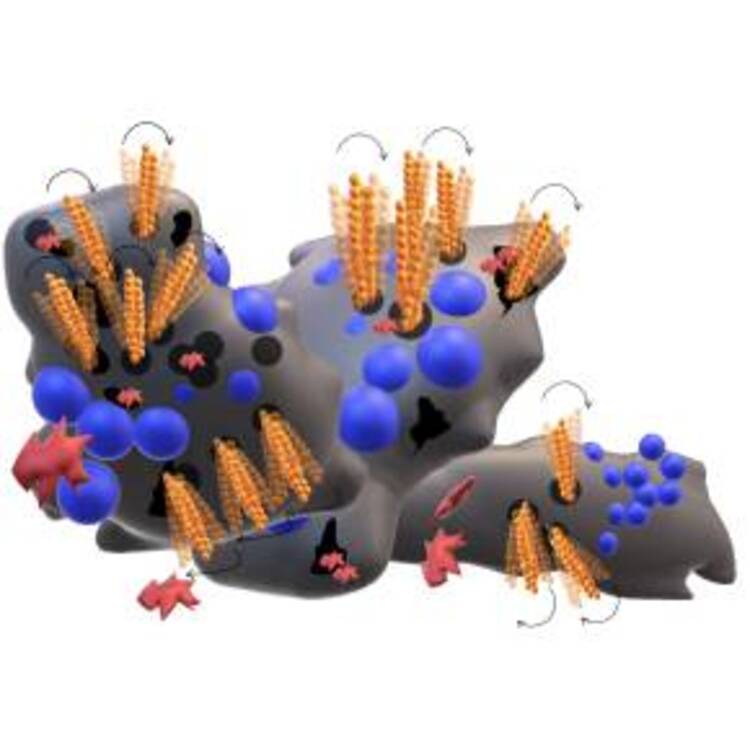
Ces nanostructures peuvent pénétrer les biofilms grâce à leur forme, propriétés magnétiques et leur potentiel zêta négatif, une propriété de surface qui les aide à interagir avec la matrice protectrice des biofilms et à s’y infiltrer. Grace au champ magnétique tournant de faible intensité et basse fréquence, elles peuvent s’activer de manière contrôlée et multidirectionnelle. Elles s’assemblent en essaims dynamiques, formant des microfagots ou micronattes, qui peuvent exercer des forces mécaniques au sein des biofilms.
Un traitement combiné pour une efficacité maximale
En
pénétrant les biofilms et en exerçant des forces mécaniques, ces
nanochaînes magnétiques perturbent la matrice extracellulaire mais ne
suffisent pas pour tuer les bactéries. Lorsqu’elles sont utilisées avec
des faibles doses d’antibiotiques (comme la méticilline), les
nanochaînes magnétiques permettent d’éliminer jusqu’à 99,99 % des
bactéries auparavant résistantes aux antibiotiques. Ce mécanisme repose
sur une combinaison de stratégies physiques et chimiques, maximisant
l’effet bactéricide en présence de l’antibiotique, mais n’altérant pas
les bactéries en l’absence d’antibiotique. Cette synergie entre l’action
mécanique des nanochaînes et l’effet des antibiotiques représente une
avancée significative dans le traitement des infections résistantes, en
particulier celles impliquant des biofilms de Staphylococcus
epidermidis.
Les nanochaînes magnétiques offrent une solution prometteuse pour surmonter la résistance bactérienne aux antibiotiques, liées à la présence de biofilm. Leur capacité à pénétrer et à perturber les structures protectrices des biofilms, combinée à leur activation contrôlée par un champ magnétique, ouvre de nouvelles perspectives pour le développement de traitements plus efficaces. Les applications potentielles de cette technologie sont vastes, allant du nettoyage des dispositifs médicaux à la gestion des infections chroniques. Les recherches futures doivent se concentrer sur l’optimisation de ces nanostructures et leur intégration dans des protocoles cliniques, afin de maximiser leur impact sur la santé publique.
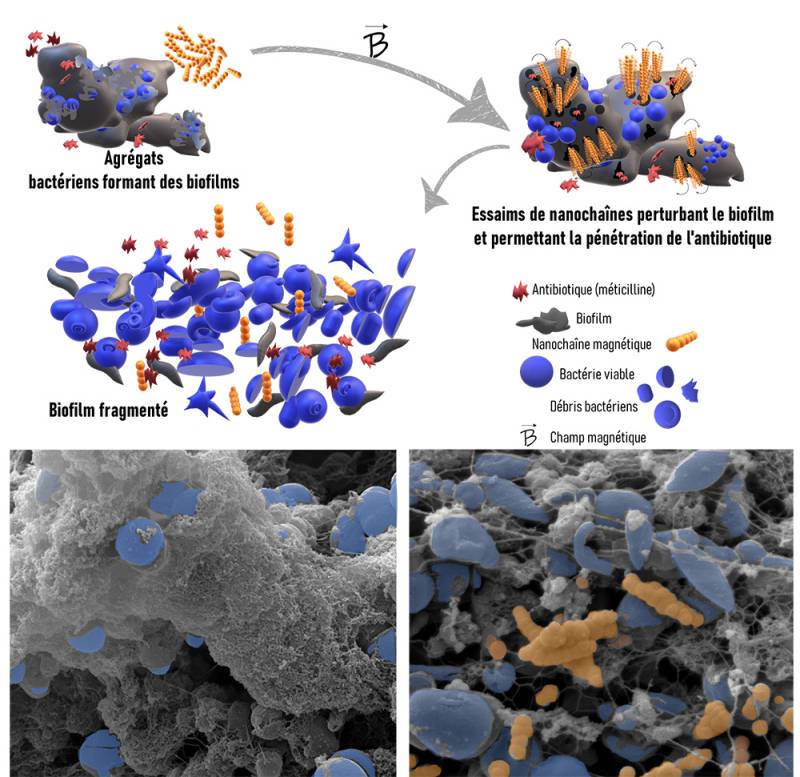
Figure : Les biofilms bactériens empêchent la pénétration et l’action des antibiotiques. En utilisant des nano chaînes magnétiques, les biofilms peuvent être déstabilisés et les antibiotiques peuvent pénétrer plus efficacement dans la matrice extracellulaire, atteignant ainsi les bactéries. Cela améliore considérablement leur effet bactéricide, même à des doses sub-inhibitrices, réduisant ainsi la résistance bactérienne et favorisant l’élimination des bactéries.